[비즈한국] 이번 주 독일 뒤셀도르프에서는 전 세계 의료기기와 헬스케어 분야의 기업들이 모이는 박람회 메디카(Medica 2023)가 열리고 있다. 메디카는 의료기기 및 헬스케어 관련 분야 세계 4대 행사 중 하나로 유럽 시장을 공략하기 위해서 관련 산업에서는 필수 참여 행사라고 해도 과언이 아니다. 올해는 70여 개국에서 5300여 개의 기업이 참석했다. 한국은 매년 참가국 수를 놓고 봤을 때 톱5에 드는 주요 국가다.

메디카 방문객들은 매년 전문 분야의 최신 트렌드를 파악하고, 더욱 혁신적인 제품과 서비스가 없는지 주목한다. 총 19개의 홀에서 5000개가 넘는 부스를 모두 둘러볼 수는 없으니, 특정 분야를 선정해 그 분야의 신기술을 찾는 것이 효율적이다. 투자 혹한기에도 바이오·헬스케어 분야는 타 분야에 비해 투자 감소폭이 적었다. 실제 규제·인증과 관련한 초기 진입 장벽이 높은 탓에 웬만한 기술력이 아니고서는 도전이 어려운 영역이기 때문이다. 북미, 아시아 등 다른 지역에 비해서 특히 유럽은 규제의 벽이 높은 것으로 악명 높다. 이러한 시장 환경은 스타트업에 불리한 것이 사실이다. 하지만 유럽에도 헬스케어 스타트업이 있다. 이들은 어떻게 규제의 벽을 넘어 성장하고 있을까.
#유럽 진출의 초기 장벽, 규제
EU는 의료기기 및 체외 진단 의료기기 안전성과 유효성을 보장하기 위한 강력한 규제인 MDR(Medical Devices Regulation)과 IVDR(In Vitro Diagnostic Medical Devices Regulation)을 각각 2021년 5월 26일, 2022년 5월 26일부터 시행하고 있다. 기존에는 규정(Directive) 수준이던 것이 규제(Regulation) 수준으로 바뀌면서 좀 더 강화된 전주기적 관리 감독이 필요한 상황이 되었다. 현재는 전환 기간을 거치고 있지만 MDR(의료기기법)은 2024년 5월 26일, IVDR(체외진단 의료기기법)은 위험 등급에 따라 2025년 5월 26일부터 2027년 5월 26일까지로 기업들이 이에 대응해야 하는 타임라인이 계속 가까워지는 중이다.
스타트업에게 인증을 위해 투자해야 하는 시간과 에너지, 그리고 실질적인 인증 비용은 고스란히 큰 손실이 된다. 유럽 시장 진출을 위해 꼭 필요한 절차지만, 이를 ‘투자’라기보다 ‘손실’이라 표현하는 것은 인증을 위해 기다리는 시간, 지연 비용 때문이다. 글로벌 대기업, 중소·중견 기업 할 것 없이 모든 의료기기 관련 기업에 인증이 필요하기 때문에 인증기관의 대기줄(waiting list)은 줄어들 기미를 보이지 않는다.

실제로 유럽 전역에 약 40개의 인증기관이 있지만, 현재 헬스케어 부문의 인증 및 재인증 수요가 너무 많아 감당할 수 없는 수준이다. 실제로 올해 3월 EU는 일부 의료기기의 인증 전환 기간을 연장했다. 이를 통해 일부 고위험 의료기기에 대해서는 2027년 12월 31일까지, 중위험 및 저위험 의료기기는 2028년 12월 31일까지 전환 기간이 연장되었다. EU 보고서에 따르면, EU 내에서 사용되고 있는 약 50만 개 의료기기와 관련해 2만 1376개의 인증서가 향후 새로운 규제에 따라 갱신돼야 하나, 법 시행 2년 반이 지난 2022년 10월 기준으로 기존 인증서의 약 10분의 1 정도만이 갱신됐으며, MDR이나 IVDR에 따라 지정된 인증기관도 아주 부족한 상황이다.
지금과 같이 투자가 어려운 시기에 투자자들은 이미 인증을 마쳤거나 인증에 관한 기본 인프라를 갖춘 스타트업을 선호한다. 투자자도 인증에 필요한 시간과 비용을 함께 감당하기에는 불확실성이 크기 때문이다. 인증을 받아야 실질적 매출이 발생하기 때문에 스타트업에게는 이 과정이 고난의 서막이다.
#유럽 메드테크 스타트업의 다양한 전략
유럽 스타트업들은 이 고난의 시간을 버티기 위해 다양한 시도를 한다. 체코 프라하에 기반을 둔 메드테크(MedTech) 스타트업 케어봇(Carebot)은 AI와 비전 알고리즘을 통해 흉부 X선과 유방촬영술(MMG) 분석과 진단을 돕는 솔루션을 개발하고 있다. 이들은 아직 유럽 시장에는 제품을 내놓지 못했다. 인증을 준비하고 있기 때문이다.
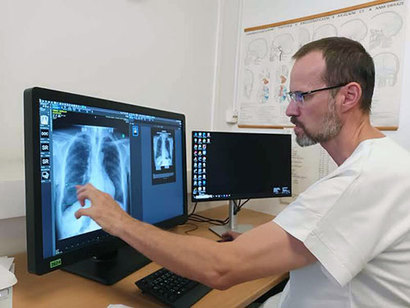
케어봇이 이 기간에 살아남기 위해 선택한 방법은 연구소 및 학교와의 협력 프로젝트다. 최근 이들은 프라하 카를대학교(Charles University), 체코과학아카데미(Czech Academy of Sciences)와 협력 연구 프로젝트를 시작했다. 제품을 시장에 내놓기 위해 준비하는 시간 동안 연구기관과 함께 제품을 고도화하고, 시장의 신뢰성을 높이기 위한 전략이다. 케어봇 CEO 다니엘 크박(Daniel Kvak)은 “유럽이 아닌 좀 더 인증이 간소화된 시장에서 첫 출시를 하는 것도 고려하고 있다”라고 밝혔다.
벨기에의 스타트업 뉴로클루스(neuroClues)도 비슷한 결정을 내렸다. 뉴로클루스는 벨기에의 의료기술 회사 IBA(Ion Beam Application)와 프랑스 ICM 뇌척추 연구소 출신이 설립했다. 2020년에 창업한 이 스타트업은 시선 추적을 사용해 파킨슨병과 같은 신경 질환의 조기 진단을 지원하는 장치를 개발하고 있다. 2022년 말 유럽혁신협의회(EIC) 액셀러레이터 프로그램으로부터 250만 유로(35억 원)의 보조금을 받은 촉망 받는 기업이다.
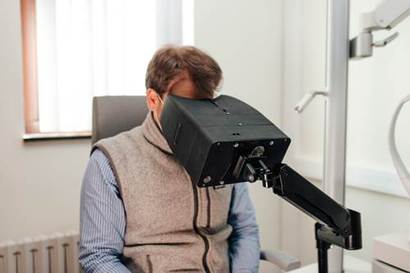
뉴로클루스는 유럽 인증 절차를 막 시작했지만 동시에 미국 식품의약국(FDA)에도 승인을 신청할 예정이다. 공동창업자이자 CEO인 앙투안 푸페즈(Antoine Pouppez)는 “FDA 승인 과정이 유럽보다 훨씬 더 잘 정의되고 구조화되어 있다. 유럽에서는 신청서 작성 이후 처리 기간을 예측하기 어렵다”고 답했다. 실제 유럽에서는 이 과정이 약 9~18개월이 걸리고, FDA는 신청서 제출 전 논의에 열려 있고, 처리 기간이 90일 이내다. 이 때문에 ‘미국 우선’을 선택하는 스타트업이 더 늘고 있다.
유럽위원회는 이러한 문제를 해결하기 위해 EU4Health 프로그램을 통해 인증기관(Notified Body)의 역량 강화를 위한 지원을 시작했다. NoBoCap(인증기관 역량 증대)이라는 이름의 프로그램인데, 이름에서 알 수 있듯이 목표는 의료기술 혁신을 처리하기 위해 인증기관의 역량을 높이는 것이다. 예를 들어 AI를 사용하는 새로운 의료기술이 도입될 때는 이를 평가할 전문가가 필요한데, 인증기관이 기존 전문가를 교육하고 새로운 인재를 확보할 비용을 지원한다.

기업들이 제품에 가장 적합한 인증기관을 선택하고 제출 서류를 잘 준비할 수 있도록 매치메이킹 포털을 구축하는 데에도 자금을 지원한다. 분야에 적합한 인증기관을 빠르게 찾을 수 있도록 돕는 것이 이 포털의 역할이다.
건강 유지 및 향유의 목적을 지닌 제품은 ‘의료기기’가 아니라 ‘웰니스’ 등의 분야로 정의하는 경우도 있다. 특히 애플리케이션이나 플랫폼을 개발하는 경우 규제를 따르는 데 들어가는 비용과 시간을 아끼기 위해 사업 영역을 재정의하는 것이다. 스톡홀름의 스타트업 레이르(Leyr)가 이를 잘 보여준다. 레이르는 건강 데이터를 수집하고 공유하는 플랫폼을 개발한다. 의료기기 간의 데이터 교환이 핵심인데, 이미 인증된 의료기기를 보유한 회사가 고객이다.
이러한 포지셔닝은 규제가 불확실한 데 따른 의도적인 전략이다. 제품은 의료기기가 아니지만, 의료기기 회사가 사용하므로 관련 산업과 시장에서의 가능성을 투자자에게 확실하게 보여줄 수 있다. 동시에 의료기기 제품으로 전환할 경험과 시간을 확보한다는 장점이 있다. 추후 인증에 필요한 데이터를 수집할 시간을 확보할 수 있다는 것도 큰 의미가 있다.
유럽 기업들에게도 의료기기와 헬스케어 분야는 진입이 힘든 시장이다. 누구에게나 똑같이 힘들다는 것은 모두가 같은 출발점에 있다는 말이다. 메디카에 온 많은 한국의 혁신 기업들이 유럽 시장 진입을 추진할 때 ‘인증’이라는 고난을 겪는다. 이런 환경에서도 살아남고 성장하는 유럽 스타트업의 전략을 살펴본다면, 그 시간은 ‘손실’이 아닌 성장을 위한 ‘투자’의 시간이 될 것이다.
필자 이은서는 한국에서 법학을 전공했고, 베를린에서 연극을 공부했다. 예술의 도시이자 유럽 스타트업 허브인 베를린에 자리 잡고 도시와 함께 성장하며 한국과 독일의 스타트업 생태계를 잇는 123factory를 이끌고 있다.
이은서 칼럼니스트
writer@bizhankook.com[핫클릭]
·
[유럽스타트업열전] 프랑스발 '빈대 소동'에 해충 퇴치 스타트업 뜬다
·
[유럽스타트업열전] 베를린 '드라이버리 마켓플레이스'서 만난 한국 모빌리티 스타트업
·
[유럽스타트업열전] 혁신을 위한 항구이자 보금자리, 보쉬 IoT 캠퍼스 방문기
·
[유럽스타트업열전] 유럽 최대 모빌리티 전시회 'IAA 2023' 최대 화두는 중국
·
[유럽스타트업열전] '혁신'의 이름으로 벌어진 사기 행각





















![[단독] 전세사기 사회주택 결국 경매로…](/images/common/list01_guide02.png)

